Informatii generale
Dihidropirimidin dehidrogenaza (DPD) este enzima care determina rata de metabolizare a bazelor pirimidinice, uracil si timidina. DPD catalizeaza de asemenea detoxifierea agentilor chimioterapici pe baza de pirimidina, 5-fluorouracil (5-FU) si capecitabin, fiind responsabila de eliminarea a ~80% din doza administrata3.
5-FU este un agent citostatic utilizat de cateva decenii in tratamentul tumorilor solide: colorectale, mamare, de cap si gat. Modul sau de actiune se bazeaza pe efectul de antimetabolit al fluoropirimidinelor, care determina un deficit de timidina prin inhibarea timidilat sintazei si conduce in final la impiedicarea sintezei ADN-ului4.
Activitatea DPD scazuta este asociata cu mielosupresie severa, uneori letala, la administrarea unor doze standard de 5-FU. Astfel, sindromul deficitului DPD se manifesta prin diaree severa, mucozita, neurotoxicitate si, in unele cazuri, deces. Acesta reprezinta un sindrom farmacogenetic real, deoarece nu poate fi identificat din punct de vedere clinic decat in mometul expunerii la agentul chimioterapic5.
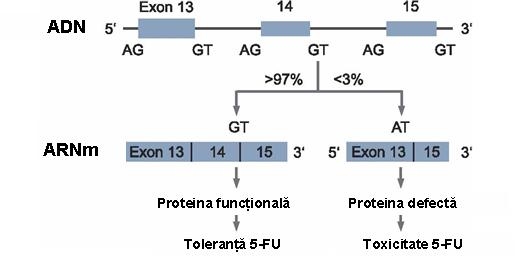
Deficitul enzimatic este cauzat in ~50% din cazuri de o mutatie la nivelul genei DPD de pe cromozomul 1, denumita IVS14+1G>A sau DPYD*2A. Mutatia consta intr-un schimb de baze G>A la nivelul jonctiunii de splicing a intronului 14 ce conduce la „omiterea” exonului 14 de la transcriptie si, astfel, la o deletie de 165 bp din DPD ARNm (vezi figura 18.2.1.1). Genotipul DPYD*2A homozigot conduce la un dficit enzimatic complet, in timp ce genotipul heterozigot este asociat cu un deficit partial4;5.
Figura 18.2.1.1 Reprezentare schematica a genei DPD, a mutatiei care duce la „omiterea” exonului 14 si a consecintelor functionale (Adaptare dupa Birgit Busse, Dihydropyrimidine dehydrogenase (DPD) – 5-FU therapy, www.medical-genetics.de)
In populatia caucaziana sunt raportate urmatoarele frecvente pentru alela IVS14+1G>A: 0.91% pentru statusul homozigot si 1.8% pentru statusul heterozigot2.
Masurarea directa a activitatii catalitice a DPD este destul de dificila, deoarece singurul tesut care contine o cantitate suficienta de enzima este tesutul hepatic, iar efectuarea biopsiei constituie o manevra invaziva pentru pacient. Alternativ au fost dezvoltate teste care determina activitatea DPD in limfocitele din sangele periferic dar si acestea prezinta protocoale de lucru laborioase, iar valorile obtinute nu se coreleaza intotdeauna cu toxicitatea 5-FU; mai este posibila si masurarea ratei de generare a metabolitului 5-FU in urma administrarii unei doze test de citostatic.
Genotiparea DPD constituie o potentiala oportunitate diagnostica pentru imbunatatirea eficacitatii si sigurantei terapiei cu 5-FU sau capecitabin. Totusi, avand in vedere faptul ca activitatea DPD ar putea fi influentata pe langa factorii genetici si de varsta, sex, stilul de viata, medicatia asociata, este nevoie de studii mai mari pentru adoptarea universala a screening-ului genetic pre-tratament combinat cu determinarea directa a activitatii enzimatice.
Pana in prezent nu exista recomandari precise privind atitudinea terapeutica la pacientii cu deficit de DPD; un pas in aceasta directie l-au efectuat Volk si colaboratorii care au raportat ca pacientii cu activitate DPD foarte scazuta au fost tratati cu succes printr-o terapie alternativa4.
Recomandari pentru genotiparea DPD
-identificarea pacientilor cu risc de a dezvolta toxicitate la administrarea de 5-FU sau capecitabin;
-stabilirea necesitatii ajustarii dozelor sau selectarii unei terapii alternative3.
Pregatire pacient – nu este necesara o pregatire speciala; pe biletul de trimitere catre laborator va fi precizat medicamentul pentru care se solicita testarea1.
Specimen recoltat – sange venos1.
Recipient de recoltare – vacutainer ce contine EDTA ca anticoagulant1.
Cantitate recoltata – cat permite vacuumul2.
Cauze de respingere a probei – folosirea heparinei ca anticoagulant; probe coagulate sau hemolizate2.
Stabilitate proba – 7 zile la 2-8ºC1.
Metoda – secventiere exon14 pentru identificarea mutatiei IVS14+1G>A1.
Raportarea si interpretarea rezultatelor
Se va raporta prezenta sau absenta mutatiei IVS14+1G>A; in cazul unui rezultat pozitiv se va comunica statusul heterozigot/homozigot1.
Limite si interferente
Testul detecteaza numai mutatia IVS14+1G>A a genei DPD. Alte mutatii nu pot fi identificate1.
Bibliografie
1. Laborator Synevo. Referinte specifice tehnologiei de lucru utilizate 2007. Ref Type: Catalog.
2. Laboratory Corporation of America. Directory of Services and Interpretive Guide. DPD 5-Fluorouracil Toxicity. www.labcorp.com, 2010. Ref Type: Internet Communication.
3. Mayo Clinic. Mayo Medical Laboratories. Test Catalog: Dihzdropzrimidine Dehydrogenase (DPD) Gene Mutation Analysis. www.mayomedicallaboratories.com. Ref Type: Internet Communication.
4. M. Eidens, S. Prause, A. Weise, M. Klemm, M.M. Weber, A. Pfützner, Dihydropyrimidine Dehydrogenase Genotyping and Phenotyping for 5-Fluorouracil Dysmetabolism: Moving Towards Personalized Chemotherapy in Patients with Cancer. In Current Pharmacogenomics and Personalized Medicine, 2009, 7, 275-283.
5. M.W. Saif, hanny Ezzeldin, Katisha Vance, Sandra Sellers, Robert B. Diasio. DPYD*2A mutation: the most common mutation associted with DPD deficiency. In Cancer Therapy and Pharmacology, Vol.60, No.4, 503-507, 2007.