Informaţii generale şi recomandări pentru testare
In practica medicală curentă este recunoscută din ce în ce mai mult importanţa determinării periodice a nivelului în sânge al multora din medicamentele administrate, fie datorită potenţialului crescut de reacţii adverse, fie complianţei reduse a pacienţilor.
Monitorizarea terapeutică a unui medicament (Therapeutic Drug Monitoring, TDM) are drept scop menţinerea concentraţiei acestuia în intervalul terapeutic, definit ca acel interval de valori ale nivelului în ser, plasmă sau sânge integral în care medicamentul respectiv îşi exercită efectele clinice cu reacţii adverse minime pentru majoritatea pacienţilor.
Conceptul de TDM se referă astfel la măsurarea concentraţiei medicamentelor pentru a optimiza şi adapta tratamentul la nivel individual (terapie personalizată). Pentru realizarea acestei ţinte terapeutice este important să se cunoască pentru medicamentele administrate date legate de:
– farmacocinetică: studiază efectele medicamentului asupra organismului (relaţia doză-efect);
– farmacodinamică: studiază efectele organismului asupra medicamentelor (absorbţie, distribuţie etc);
– farmacogenetică: studiază modelul genetic al metabolizării medicamentelor luând în considerare variaţiile individuale.
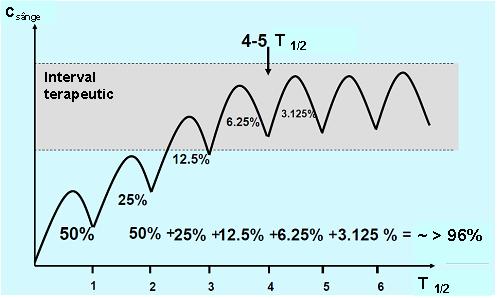
Pentru a obţine rezultate pentru concentraţiile medicamentoase cu utilitate clinică este important ca proba să fie recoltată în aşa numita „steady state” (stare de echilibru) în care rata de medicament ce pătrunde în organism este egală cu cea eliminată. Atunci când o doză fixă de medicament este administrată la intervale de timp regulate, acesta se va acumula în organism în cursul fazei de absorbţie până este atinsă starea de echilibru; perioada de timp necesară pentru a se ajunge la steady state depinde de timpul de înjumătăţire al medicamentului (T1/2), adică timpul în care concentraţia medicamentului în sânge se reduce la jumătate. La rândul său T1/2 depinde de rata de metabolizare şi excreţie. In condiţiile unei distribuţii rapide şi uniforme a medicamentului în organism (cinetica de ordinul I), precum şi în absenţa unei doze de încărcare, este nevoie de un interval de timp echivalent cu cel puţin 5 T1/2 pentru a obţine steady state (vezi fig. 20.3.1)1;2;4.
Fig 20.3.1 Obţinerea „steady state”
Acest proces poate fi rezumat astfel:
k
D→E D = concentraţia medicamentului E = forma excretata a medicamentului
k = constanta de dispariţie a lui D
T1/2 = 0.693/k
Aşa cum reiese din ecuaţie, T1/2 este o constantă şi nu depinde de concentraţia medicamentului. Daca T1/2 este cunoscut se poate calcula modul de împărţire a dozelor şi intervalul de timp la care trebuie administrate pentru a se atinge nivelul terapeutic.
Totuşi, unele medicamente sunt metabolizate printr-un alt tip de cinetică decât cea de ordinul I, suferind mai întâi o metabolizare în ficat, urmată de o distribuţie multicompartimentală în organism (medicamentul are o anumită rată de distribuţie plasmatică şi o rată diferită de distribuţie tisulară). In aceste cazuri timpul necesar pentru a atinge steady state poate să fie diferit de echivalentul a 5 T1/2 .
Cu excepţia urgenţelor medicale, în cazurile în care se modifică dozele administrate şi se adaugă sau se scot medicamente asociate, se va aştepta obţinerea unei noi stări de echilibru înainte de recoltarea probei pentru monitorizarea terapeutică. Intr-un mod similar, se va aştepta aceeaşi perioadă de timp până când un medicament aflat în steady state se va elimina din organism la întreruperea administrării2.
Odată atinsă starea de echilibru probele de sânge pot fi recoltate în două momente diferite:
-în momentul nivelului maxim (peak samples): la 2-3 ore după administrarea unei doze orale, la 30-60 minute după o doză administrată intravenos, la 2-4 ore după o doză administrată intramuscular sau la 1-1 şi ½ ore după o doză administrată intranazal;
-în momentul nivelului minim (trough samples): imediat înaintea administrării următoarei doze; acest moment este recomandat în majoritatea cazurilor.
Monitorizarea terapeutică a medicamentelor este indicată în special în următoarele situaţii:
Clasele de medicamente pentru care se recomandă în mod special TDM sunt următoarele:
- glicozide cardiace: digoxin. digitoxin;
- antiaritmice: amiodarona, flecainida, procainamida, chinidina;
- antiastmatice: teofilina;
- antibiotice: aminoglicozide, vancomicina;
- antivirale: medicamentele pentru infecţia HIV, ganciclovir;
- anticonvulsivante: fenobarbital, carbamazepin, fenitoin, acid valproic, gabapentin, primidona, lamotrigin;
- medicamente psihotrope: litiu, antidepresive triciclice, neuroleptice;
- imunosupresoare: ciclosporina, tacrolimus, sirolimus, everolimus, acid micofenolic, azatioprina;
- citostatice: methotrexat1;2
In tabelul de mai jos sunt precizate pentru anumite medicamente T1/2, intervalul de timp necesar pentru a se ajunge la steady state, tipul de probă pentru TDM şi stabilitatea acesteia, intervalul terapeutic1;4:
|
MEDICAMENT |
T1/2 |
T până la steady state |
Tip probă |
Stabilitate probă |
Metodă de determinare |
Interval terapeutic |
|
Digoxin |
36-48 h |
7-10 zile |
Ser |
7 zile la 2-8°C |
ECLIA |
0.9-2 ng/mL |
|
Amiodarona |
26-107 zile |
Nu se aplică |
Ser |
7 zile la 2-8°C |
HPLC |
0.5-2 mg/L |
|
Flecainida |
12-27 ore |
3-6 zile |
Ser |
7 zile la 2-8°C |
HPLC |
0.2-0.8 mg/L |
|
Teofilina |
7-11 ore (adult) 1-8 ore (copil)
|
15-55 ore (adult) 5-40 ore (copil) |
Ser |
7 zile la 2-8°C |
HPLC |
< 1 an: 5-10 mg/L ≥ 1 an: 8-20 mg/L |
|
Vancomicina |
3-8 ore |
1-2 zile |
Ser |
7 zile la 2-8°C |
FPIA |
5 – 10 µg/mL
|
|
Carbamazepin |
14-47 ore (adult) 8-19 ore (copil) |
7-12 zile (adult) 2-4 zile (copil) |
Ser |
7 zile la 2-8°C |
HPLC |
4-10 mg/L |
|
Acid valproic |
9-16 ore (adult) 7-13 ore (copil) |
2-4 zile (adult) 2-4 zile (copil) |
Ser |
7 zile la 2-8°C |
CEDIA |
50-100 mg/L |
|
Topiramat |
19-23 ore |
5 zile |
Ser |
7 zile la 2-8°C |
HPLC |
1-10 mg/L |
|
Etosuximid |
50-60 ore (adult) 30 ore (copil) |
8-12 zile (adult) 6-10 zile (copil) |
Ser |
7 zile la 2-8°C |
HPLC |
40-100 mg/L |
|
Fenobarbital |
81-117 ore (adult) 40-70 ore (copil) |
17-24 zile (adult) 8-15 zile (copil) |
Ser |
7 zile la 2-8°C |
HPLC |
10-40 mg/L |
|
Fenitoin |
18-22 ore (adult) 7-29 ore (copil) |
4-8 zile (adult)
2-5 zile (copil) |
Ser |
7 zile la 2-8°C |
HPLC |
<14 ani: 10-20 mg/L >14 ani: 6-14 mg/L |
|
Gabapentin |
5-7 ore (adult) 4-6 ore (copil) |
1-2 zile (adult) 1-2 zile (copil) |
Ser |
7 zile la 2-8°C |
HPLC |
2 – 10 µg/mL |
|
Lamotrigin |
15-30 ore (adult) 30 ore (copil) |
3-10 zile (adult) 3-10 zile (copil) |
Ser |
7 zile la 2-8°C |
HPLC |
<14 ani: 5-15 mg/L >14 ani: 1-5 mg/L |
|
Primidona |
3-7 ore (adult)
4-6 ore (copil) |
16-60 ore (adult) 20-30 ore (copil) |
Ser |
7 zile la 2-8°C |
HPLC |
5-15 mg/L |
|
Amitriptilina |
8-51 ore |
2-6 zile |
Ser |
7 zile la 2-8°C |
LC-MS/MS |
50-300 µg/L |
|
Litiu |
14-30 ore |
2-7 zile |
Ser |
8 ore la temperatura camerei; 24 ore la 2-8°C; 6 luni la -18°C |
ISE |
Mania acuta: 0.6-1.2 mmol/L. • Protecţie impotriva viitoarelor episoade la pacienţii cu afecţiune bipolara: 0.8-1.0 mmol/L. • Depresie: 0.5- 1.5 mmol/L |
|
Clomipramin |
12-36 ore |
3 săptămâni |
Ser |
7 zile la 2-8°C |
LC-MS/MS |
90-250 µg/L |
|
Clozapina |
4-66 ore |
Nu se aplica |
Ser |
7 zile la 2-8°C |
LC-MS/MS |
350-600 µg/L |
|
Olanzapin |
21-54 ore (adult ≤65 ani) 32-81 ore (adult >65 ani) |
7 zile |
Ser |
7 zile la 2-8°C |
LC-MS/MS |
10-80 µg/L |
|
Doxepin |
8-25 ore |
2.5-5 zile |
Ser |
7 zile la 2-8°C |
LC-MS/MS |
20-150 µg/L |
|
Imipramin |
6-20 ore |
2-5 zile |
Ser |
7 zile la 2-8°C |
LC-MS/MS |
45-150 µg/L |
|
Maprotilin |
36-105 ore |
14 zile |
Ser |
7 zile la 2-8°C |
LC-MS/MS |
125-200 µg/L |
|
Trimipramin |
16-39 ore |
Nu se aplica |
Ser |
7 zile la 2-8°C |
LC-MS/MS |
150-350 µg/L |
|
Haloperidol |
41-41 ore (lactat); 14-28 zile (decanoat) |
3-9 zile (lactat); nu se aplica |
Ser |
7 zile la 2-8°C |
LC-MS/MS |
5-16 µg/L |
|
Risperidon |
3 ore (fast metabolizerrisperidon); 21 ore (fast metabolizer9-hidroxi-risperidon); 20 ore (slow metabolizerrisperidon); 30 ore (slow metabolizer9-hidroxi-risperidon) |
1 zi (fast metabolizerrisperidon); 5-6 zile (fast metabolizer9-hidroxi-risperidon); 5 zile (slow metabolizerrisperidon); nu se aplica (slow metabolizer9-hidroxi-risperidon) |
Ser |
7 zile la 2-8°C |
LC-MS/MS |
10-120 µg/L |
|
Ciclosporina A |
6-27 ore |
2-6 zile |
Sânge EDTA |
5 zile la -20°C |
LC-MS/MS |
Intervalul terapeutic variază în funcţie de tipul transplantului şi perioada de timp de la transplant. Pentru afecţiuni dermatologice şi reumatologice:<100 µg/L Pentru sindrom nefrotic: 60-160 µg/L |
|
Tacrolimus |
4-35 ore (adult); 4-12 ore (copil) |
2-6 zile (adult); nu se aplică la copil |
Sânge EDTA |
5 zile la -20°C |
LC-MS/MS |
– în primele 2 luni de la transplant: 15-20 µg/L – după 2 luni de la transplant: 8-15 µg/L |
|
Sirolimus |
46-78 ore |
5-7 zile |
Sânge EDTA |
5 zile la -20°C |
LC-MS/MS |
4-20 µg/L |
|
Acid micofenolic |
8-18 ore (adult); variabil la copil |
Nu se aplică |
Ser |
7 zile la 2-8°C |
HPLC |
1-3.5 µg/mL |
|
Methotrexat |
Cinetica bifazică |
– |
Ser
|
7 zile la 2-8°C protejat de lumină |
FPIA |
Se asociază cu un risc crescut de toxicitate: – valorile > 5-10 µmol/L la 24h de la admistrare; – valorile > 0.5-1 µmol/L la 48h de la administrare; – valorile > 0.2 µmol/L la 72h de la administrare |
ECLIA = metoda imunochimică cu detecţie prin chemiluminiscenţă
HPLC = cromatografie de lichide sub înaltă presiune
LC-MS/MS = cromatografie de lichide cuplată cu spectrometrie de masă
FPIA = fluorescent polarization immunoassay (metoda imunochimică cu detecţie prin fluorescentă polarizată)
CEDIA = cloned enzyme donor immunoassay (metoda imunoenzimatică care utilizează tehnologia ADN-ului recombinant)
ISE = ion selective electrode (metoda potenţiometrică)
Medicamente imunosupresoare
In timp ce integritatea răspunsului imun umoral şi celular este esenţială pentru prevenirea infecţiilor, în unele situaţii, cum ar fi bolile autoimune şi transplantul de organe solide, devine vital să se suprime activitatea acestor sisteme.
In statusul post-transplant este implicată imunitatea de tip celular. Atat în cazul reacţiilor grefa-contra-gazdă cat şi a celor gazdă-contra-grefă limfocitele T CD4+ sunt activate atunci cand un antigen străin se leagă de antigenele HLA clasa a II-a de pe suprafaţa macrofagelor (celulele prezentatoare de antigen). Clonele de celule T specifice se vor lega de antigen prin intermediul receptorului celulei T (TCR); activarea TCR rezultă într-o “cascada” de transducţie a semnalului care va conduce în final la endocitoza antigenului în macrofage şi distrugerea acestuia în lizozomi. In această cascadă sunt mobilizati ionii de calciu care determină activarea calcineurinei, o fosfatază ce formează un complex cu calmodulinul. Calcineurina activată defosforilează factorul nuclear citosolic al celulelor T activate (NF-AT)C si astfel îl activează; acesta migrează către nucleu şi se leagă de omologul său (NF-AT)N. Complexul transcripţional activ rezultat va induce sinteza de interleukină-2 (IL-2) care va fi secretată ca un mitogen extracelular. IL-2 se leagă de receptorul său situat pe limfocitul T, pe care îl activează prin legarea unei proteine, denumită “ţintă rapamicinei” (target of rapamycin = TOR); această proteină activează ciclin-kinazele care facilitează progresia ciclului celular din G1 in S şi stimulează sinteza nucleotidelor. Procesul are ca rezultat diferenţierea şi proliferarea celulelor T şi va conduce în final la distrugerea antigenului.
Au fost dezvoltate medicamente specifice care blochează una sau mai multe din etapele menţionate mai sus, inhiband astfel distrugerea antigenului.
Ciclosporina şi tacrolimusul sunt polipeptide ciclice care se leagă de proteinele intracelulare denumite imunofiline (ciclosporina se leagă de ciclofilină, în timp ce tacrolimusul se leagă de imunofilina denumită FKBP12), rezultand complexe ce blochează ulterior activarea NF-AT indusă de calcineurină şi în consecinţă sinteza de IL-2.
Un alt agent imunosupresor – rapamicină (sirolimus) – nu exercită nici un efect asupra celulelor T, în schimb se leagă de proteină TOR cu rol critic în activarea celulei T.
Micofenolatul mofetil (MMT) este un antibiotic ce este hidrolizat în celule în acid micofenolic liber. Acest agent este un inhibitor potent al inozin-monofosfat dehidrogenazei şi al guanozin-monofosfat sintetazei, împiedicand în final sinteza ADN-ului.
Corticosteroizii exercită de asemenea efecte imunosupresoare asupra imunităţii mediate celular, dar acestea sunt mult mai puţin specifice şi insoţite de numeraose reacţii adverse2.
Tacrolimus
Este un antibiotic din clasa macrolidelor cu un mecanism de actiune similar ciclosporinei, dar cu un efect inhibitor mai potent decat acesta. Este utilizat în prevenirea rejetului de organ.
Tacrolimus este metabolizat în ficat de către CYP3A4, astfel că nivelurile sale în sange sunt afectate atat de medicamentele care inhibă această enzimă (blocante ale canalelor de calciu, antifungice, unele antibiotice), cat şi de cele care induc activitatea enzimatică (anticonvulsivante, rifampicina).
Deoarece 90% din tacrolimus se găseşte în componentele celulare din sange se recomandă ca nivelurile medicamentului să fie determinate în probe de sange integral. Concentraţiile obţinute în trough samples pot varia în funcţie de protocolul clinic, tipul alogrefei, riscul de rejet, administrarea concomitentă a unor alte imunosupresoare şi toxicitate (în principal nefrotoxicitate), însă nu trebuie sa depăşească 20 µg/L.
Potenţialul toxic este similar celui al ciclosporinei: nefrotoxicitate, neurotoxicitate (tremor, cefalee), tulburări gastrointestinale (greaţă, diaree), HTA, perturbarea metabolismului glucozei, hiperkaliemie şi complicaţii infecţioase. Totuşi nu apare hipertrofie gingivală şi nici hirsutism. Anafilaxia este descrisă numai în cazul administrării intravenoase2;3.
Bibliografie